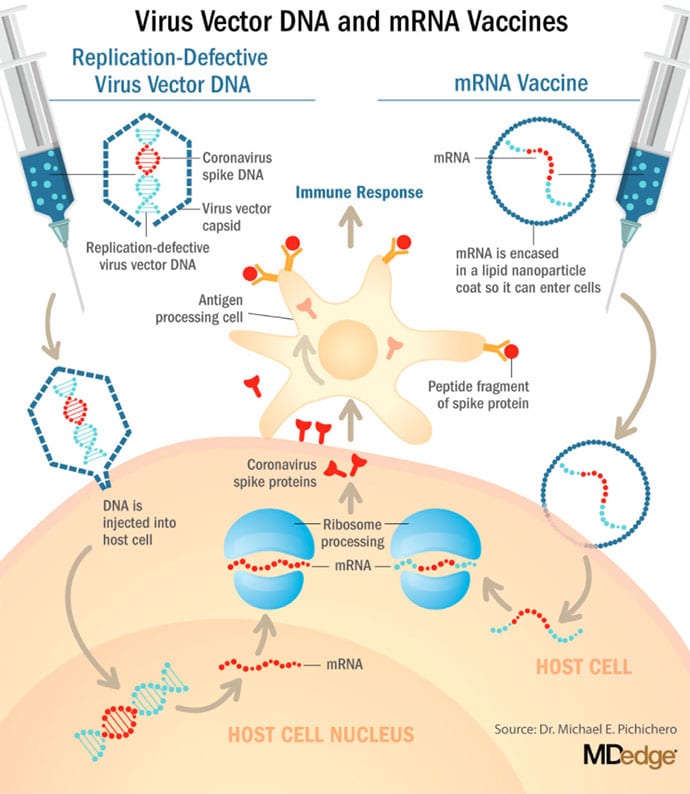
Acestea sunt vaccinuri noi și revoluționare, deși capacitatea noastra de a injecta ARNmesager la animale datează din 1990, progresele tehnologice îl fac astăzi o realitate si la om. Vaccinurile tradiționale implică de obicei injecția cu antigeni cum sunt proteinele purificate sau polizaharide sau chiar fragmente de viruși inactivați / atenuați (prajiti cum le zic eu). Vaccinurile cu ARNm funcționează diferit, nu conțin antigeni ci conțin un mesaj, o informatie: plan/schita/proiect dupa care celula va crea antigenul la care apoi organismul va produce anticorpi - speram noi neutralizanti. Acest mesaj/blueprint este introdus in celula sub formă de material genetic, mARN sau ARNmesager.
În cazul vaccinurilor Pfizer și Moderna, ARNm oferă informații genetice pentru a sintetiza proteina spike pe care virusul SARS-CoV-2 o folosește pentru a se atașa și a infecta celulele umane. Fiecare tip de vaccin este ambalat în nanoparticule lipidice proprietare pentru a proteja ARNm de degradarea rapidă, iar nanoparticulele servesc drept adjuvant pentru a atrage celulele imune la locul de injectare. (Proprietățile ambalajului respectiv de nanoparticule lipidice poate fi factorul care afectează cerințele de stocare la temperaturi ultra joase despre care vom relata mai tarziu.)
Când sunt injectate în mușchi (miocit), nanoparticulele lipidice care conțin ARNm în interior sunt preluate în celulele musculare, unde ribozomii citoplasmatici detectează și decodează mARN rezultând în producerea antigenului proteic spike.
Trebuie remarcat faptul că ARNm nu intră în nucleu,
unde se află informația genetică (ADN) a unei celule și mesajul transportat de el nu poate fi reprodus sau integrat în ADN sub nicio forma. Antigenul este exportat pe suprafața celulelor miocitelor, unde celulele prezentatoare de antigen ale sistemului imunitar detectează proteina, o ingerează și o duc la ganglionii limfatici regionali, unde interacțiunile cu celulele T și celulele B duc la anticorpi, imunitate mediată de celule T și generare de celule T de memorie imună și celule B. Un anumit subgrup de celule T - celule T citotoxice sau ucigașe - distruge celulele care au fost infectate de un agent patogen. S-a raportat că vaccinul SARS-CoV-2 mARN de la Pfizer induce răspunsuri puternice cu celule T citotoxice.
Rezultatele pentru vaccinul Moderna nu fuseseră raportate la momentul pregătirii acestui articol, dar anticipez aceleași rezultate pozitive. Aspectul revoluționar al vaccinurilor cu ARNm este viteza cu care pot fi proiectate și produse. Acesta este motivul pentru care conduc grupul printre candidații la vaccinul SARS-CoV-2 și de ce Institutul Național de Alergii și Boli Infecțioase a oferit sprijin financiar, tehnic și / sau clinic. Într-adevăr, odată ce secvența de aminoacizi a unei proteine poate fi determinată (o sarcină relativ ușoară în zilele noastre) este simplă sintetizarea ARNm în laborator - și se poate face incredibil de repede. Se raportează că codul de ARNm pentru vaccin de către Moderna a fost realizat în 2 zile și dezvoltarea producției a fost finalizată în aproximativ 2 luni.
Un raport al Organizației Mondiale a Sănătății din 2007 a remarcat faptul că bolile infecțioase apar acum la o „rata fără precedent de una pe an” .3 Sindromul respirator acut sever (SARS), Zika, Ebola și gripa aviară și porcină sunt exemple recente. Pentru majoritatea vaccinurilor împotriva bolilor emergente, provocarea este legată de rapiditate: dezvoltarea și fabricarea unui vaccin și furnizarea acestuia către persoanele care au nevoie de el cât mai repede posibil. Vaccinul gripal sezonier actual durează aproximativ 6 luni pentru a se dezvolta; durează ani pentru majoritatea vaccinurilor tradiționale. De aceea, odată ce infrastructura este pusă la punct, vaccinurile ARNm se pot dovedi a oferi un mare avantaj ca vaccinuri împotriva agenților patogeni emergenți. Rezultatele timpurii ale eficacității au fost surprinzătoare Ambele vaccinuri au fost raportate pentru a produce aproximativ 95% eficacitate în analiza finală. Aceasta a fost neașteptat de mare, deoarece majoritatea vaccinurilor pentru bolile respiratorii ating eficacitatea de 60% -80%, de exemplu, vaccinurile antigripale.
Cu toate acestea, rata eficacității poate scădea odată cu trecerea timpului, deoarece stimularea excelenta imunității pe termen scurt ar aparea in mod obisnuit doar în primele rezultate raportate. Prevenirea cazurilor de SARS-CoV-2 este un aspect important al unui vaccin coronavirus, dar prevenirea bolilor severe este deosebit de importantă, având în vedere că cazurile severe pot duce la intubație prelungită / ventilație artificială, invaliditate prelungită și deces.
Pfizer / BioNTech nu a comunicat nicio informație privind defalcarea cazurilor grave, pana in momentul publicarii acestui articol. În studiul clinic Moderna, un obiectiv secundar a analizat cazurile severe de COVID-19 și a inclus 30 de cazuri severe (definite conform protocolului de studiu) în această analiză. Toate cele 30 de cazuri au apărut în grupul placebo și niciunul în grupul vaccinat cu mARN-1273. În studiul Pfizer / BioNTech au existat prea puține cazuri de boală severă pentru a calcula eficacitatea. Durata imunității și necesitatea revaccinării după vaccinarea primară inițială sunt momentan necunoscute. Producerea imunitatii si inducerea memoriei celulelor B și T și nivelurile de protecție pe termen lung nu au fost raportate până acum.
Vaccinurile ARNm COVID-19 ar putea fi periculoase pe termen lung?
Acestea vor fi primele vaccinuri ARNm umane puse pe piață. Pentru a primi aprobarea FDA (Food and Drug Administration), companiile au trebuit să demonstreze că nu au existat efecte negative negative imediate sau pe termen scurt din vaccinuri. Companiile au raportat că comitetele lor independente de monitorizare a datelor „nu au raportat probleme serioase de siguranță”. Cu toate acestea, reacții locale destul de semnificative la locul injectării, febră, stare generală de rău și oboseală apar cu o frecvență modestă după vaccinările cu aceste produse, se pare că la 10% -15% dintre vaccinați, deci ceva mai mult decat la vaccinurile antigripale. În general, profilul reacției imediate pare a fi mai sever decât ceea ce apare după vaccinarea gripală sezonieră.
Când vor începe vaccinările în masă cu aceste vaccinuri complet noi și revoluționare, nu vom ști practic nimic despre efectele lor secundare pe termen lung. Posibilitatea răspunsurilor inflamatorii sistemice care ar putea duce la afecțiuni autoimune, persistența expresiei imunogene induse, dezvoltarea anticorpilor autoreactivi și efectele toxice ale componentelor de eliberare au fost ridicate ca preocupări teoretice. 4-6 Niciunul dintre aceste riscuri teoretice nu a fost observat data și faza 4 post-comercializare au fost efectuate studii de monitorizare a siguranței de la Centrele pentru Controlul și Prevenirea Bolilor și de la companiile care produc vaccinurile. Acesta este un risc pe care autoritățile de sănătate publică sunt dispuse să și le asume, deoarece calculul riscului beneficiilor favorizează în mod semnificativ asumarea riscurilor teoretice, în comparație cu beneficiile clare în prevenirea bolilor severe și a decesului.
Dar despre disponibilitate?
Pfizer / BioNTech se așteaptă să poată produce până la 50 de milioane de doze de vaccin în 2020 și până la 1,3 miliarde de doze în 2021. Moderna se așteaptă să producă 20 de milioane de doze până la sfârșitul anului 2020 și 500 de milioane până la 1 miliard de doze în 2021. cerințele sunt inerente compoziției vaccinurilor cu sistemele lor diferite de livrare a nanoparticulelor lipidice. BNT162b2 de la Pfizer / BioNTech trebuie depozitat și transportat la –80 ° C, ceea ce necesită congelatoare speciale, pe care este puțin probabil ca majoritatea cabinetelor medicilor și farmaciilor să le aibă la fața locului sau containere de gheață uscată. Odată ce vaccinul este dezghețat, acesta poate rămâne în frigider doar 24 de ore.
ARNm-1273 al Modernei va fi mult mai ușor de distribuit. Vaccinul este stabil într-un congelator standard la –20 ° C timp de până la 6 luni, într-un frigider până la 30 de zile în perioada de valabilitate de 6 luni și la temperatura camerei până la 12 ore.
Cronologie și testarea altor vaccinuri
Datele puternice de eficacitate din cele două vaccinuri SARS-CoV-2 și autorizația de utilizare în caz de urgență aprobarea FDA (Food and Drug Administration) sugerează că fereastra pentru testarea candidaților suplimentari la vaccin în Statele Unite ar putea începe în curând să se închidă. Dintre cele peste 200 de vaccinuri în curs de dezvoltare pentru SARS-CoV-2, cel puțin 7 au șansa de a colecta date esențiale înainte ca primele să devină disponibile pe scară largă.
Testarea diferiților candidați la vaccin, bazată pe diferite tehnologii, este importantă pentru asigurarea unei aprovizionări suficiente și ar putea duce la produse cu profiluri de tolerabilitate și siguranță care să le facă mai potrivite sau mai atractive pentru subseturile populației. Diferitele antigene și tehnologii vaccinale pot produce, de asemenea, durate diferite de protecție, întrebare la care nu se va răspunde decât după mult timp după primele produse pe piață.
AstraZeneca a înscris aproximativ 23.000 de subiecți în cele două studii de fază 3 ale AZD1222 (ChAdOx1 nCoV-19 spike): un studiu din SUA cu 40.000 de subiecți și un studiu cu 10.000 de subiecți în Brazilia. AZD1222 al AstraZeneca, dezvoltat împreună cu Universitatea din Oxford (Anglia), folosește un vector de adenovirus simian defect de replicare numit ChAdOx1. AZD1222 care codifică proteina SARS-CoV-2 spike. După injectare, vectorul viral furnizează ADN recombinant care este decodificat în ARNm, urmat de decodarea ARNm pentru a deveni o proteină. O eroare de fabricație neasteptata pentru primele 3.000 de doze a dus la administrarea a doar o jumătate de doză pentru acei subiecți, înainte ca eroarea să fie descoperită. Au fost administrate doze complete acelor subiecți la a doua injecție și acei subiecți au prezentat o eficacitate de 90%. Dar surprinzator, subiecții cărora li s-au administrat 2 doze complete au prezentat o eficacitate de 62%.
Un vaccin nu poate fi autorizat pe baza a 3.000 de subiecți, așa că AstraZeneca a început un nou studiu de fază 3 care implică mai mulți subiecți pentru a primi doza mai mică combinată urmată de doza completă.
Johnson și Johnson (J&J) au început studiul de fază 3 evaluând o doză unică de JNJ-78436735 în septembrie. Datele de fază 3 pot fi raportate până la sfârșitul anului 2020. În noiembrie, J&J a anunțat că începe un al doilea studiu de fază 3 pentru a testa două doze de candidat. JNJ-78436735 al lui J & J codifică proteina vârf SARS-CoV-2 într-un vector serotip adenovirus 26 (Ad26), care este unul dintre cei doi vectori adenovirus utilizați în Sputnik V, vaccinul rus a raportat că are o eficacitate de 90% la o analiză intermediară timpurie .
Sanofi și Novavax dezvoltă vaccinuri pe bază de proteine, o metodă dovedită. Sanofi, în parteneriat cu GlaxoSmithKline, a început un studiu clinic de fază 1/2 în toamna anului 2020 cu planuri de a începe un studiu de fază 3 la sfârșitul lunii decembrie. Sanofi a dezvoltat ingredientele proteice, iar GlaxoSmithKline a adăugat unul dintre adjuvanții lor noi. Novavax așteaptă date dintr-un studiu de fază 3 din Marea Britanie cu NVX-CoV2373 la începutul anului 2021 și a început un studiu de fază 3 din SUA la sfârșitul lunii noiembrie. NVX-CoV2373 a fost creat folosind tehnologia nanoparticulelor recombinante Novavax pentru a genera antigen derivat din proteina coronavirus spike și conține adjuvant Matrix-M pe bază de saponină brevetat de Novavax.
Inovio Pharmaceuticals se pregătea să înceapă un studiu american de fază 2/3 cu vaccin ADN INO-4800 până la sfârșitul anului 2020. După Moderna și Pfizer-BioNTech, CureVac are următorul cel mai avansat vaccin ARNm. S-a planificat ca un proces de fază 2b / 3 al CVnCoV să se desfășoare în Europa, America Latină, Africa și Asia.
Sanofi dezvoltă, de asemenea, un vaccin ARNm ca al doilea produs, pe lângă vaccinul său proteic. Vaxxinity a planificat să înceapă testarea fazei 3 a UB-612, un vaccin pe bază de peptide multitop, în Brazilia până la sfârșitul anului 2020. Cu toate acestea, autorizațiile de utilizare de urgență pentru vaccinurile Pfizer și Moderna ar putea împiedica recrutarea studiilor în cel puțin două moduri. Având în vedere gravitatea pandemiei, unele părți interesate consideră că ar fi etic să se dez-orbească studiile în curs pentru a oferi tuturor subiecților posibilitatea de a trece la un vaccin dovedit a fi eficient. Chiar dacă nu are loc unblinding, deoarece cele două vaccinuri autorizate încep să devină disponibile pe scară largă, voluntariatul pentru studii clinice poate deveni mai puțin atractiv.
Autorul, dr Pichichero este specialist în boli infecțioase pediatrice și director al Institutului de Cercetare de la Spitalul General Rochester (N.Y.). El a spus că nu are informații financiare relevante. Trimiteți un e-mail la Pichichero la [email protected].
Bibliografie
1. Wolff JA et al. Science. 1990 Mar 23. doi: 10.1126/science.1690918.
2. Jackson LA et al. N Engl J Med. 2020 Nov 12. doi: 10.1056/NEJMoa2022483.
3. Prentice T and Reinders LT. The world health report 2007. (Geneva Switzerland: World Health Organization, 2007).
4. Peck KM and Lauring AS. J Virol. 2018. doi: 10.1128/JVI.01031-17.
5. Pepini T et al. J Immunol. 2017 May 15. doi: 10.4049/jimmunol.1601877.
6. Theofilopoulos AN et al. Annu Rev Immunol. 2005. doi: 10.1146/annurev.immunol.23.021704.115843.
Acest articol a apărut inițial pe MDedge.com, parte a rețelei Medscape Professional.
 | Daniel GaneaMedic la ConsultatiiLaDomiciliu.ro |
Dr. Daniel Ganea este "Doctorul tău", Medic Specialist Medic de familie, medic rezident cardiologie, cu Competență în Ecografie și scrie aici articole pentru pacienți. A început cariera ca medic specialist în 2009 în Urgență, a lucrat și pe Ambulanță, aflând ce-și doresc de la medic pacienții care solicită online consultații medicale cu medic specialist la domiciliu.
Dacă ai citit Termeni și condiții, fă o programare online sau telefonic: